本校參加宜蘭縣scratch競賽榮獲佳績!
本校參加中小學科學展覽比賽榮獲佳績!!
恭喜!
如果你可以看到這篇文章,表示註冊過程已經順利完成。現在你可以開始blogging了!
鹿林慧星
鹿林彗星 網路直播 |
| ||
由國人首次命名的「鹿林彗星」,昨、今晚位置剛好就在土星附近,嘉義市天文協會與中央大學天文所「鹿林山天文台」合作,將透過網路直播,把鹿林彗星影像向全世界播放。 嘉義市天文協會總幹事黃傅俊指出,嘉義地區最佳觀察鹿林彗星升起時間,昨、今晚8時至9時,本月25日至27日晚上7時至8時30分,市區受到光害影響,肉眼觀看不容易,民眾仍可試著往東邊方向仰角35度望去,最亮星星就是土星,周遭就是鹿林彗星。 黃傅俊說,最佳觀察地點在塔塔加、最近地點在梅山鄉太平山,民眾若沒空去看,在「諸羅城星空天文」網站中,開辦「台灣之光鹿林彗星」網路直播,由天文專家實地解說,讓民眾對鹿林彗星有進一步的認識。 嘉義市天文協會今年與中央大學天文所合作,辦理「全民彗星留影簽名活動」,民眾可以使用單眼數位相機朝彗星方位拍攝,或把「鹿林彗星網路直播」節目中的彗星影像拍攝下來,有機會獲獎品。 可洽諸羅城星空網站http://webcast.ltes.cy.edu.tw/Ch-Astro/。 | ||
乾電池與鉛蓄電池之簡介
文章出處:引用自http://aer2.sbc.edu.hk/~yhk/Student%20project/CHEM%20web/new_page_1.htm
利用化學作用來產生電能,這種設備統稱為電池 ( cells or batteries ) 。而所謂第一級電池 ( primary cells ) 的,是利用化學作用產生電,而不能很容易的復回的,而第二級電池 ( secondary cells ) ,化學作用產生電後,可以用電能反復原來的化學作用的,所以電池可以放電充電往復利用,也就是第二種電池萬以用來儲蓄電能的,也就是中第名稱的由來。
[@more@]
最普通的第一級電池是乾電池 ( dry cells ),是用鋅儲器作為一極,中心碳極作為另一極。電極液是氯化銨和氯化鋅的水溶液,被吸收在麵粉或澱粉利二氧化錳粉中。二氧化錳是用作為支極化劑 ( depolarizer ) 。普通並加入些右墨粉,用來增加傳導度。整個電池是裝在紙板匣中。
最重要的第二次電池,是鉛蓄電池 ( lead storage battery ),他們的電極是放置在流酸溶液中。
在正極成陰極的過氧化欽極板上的反應,是
PbO2(s) + 4 H+(aq) + 2e- –>Pb2+(aq) + 2H2O(l)
Pb2+(aq) + SO4(aq) –>PbSO4(s)
PbO2(s) + 4H+(aq) + SO4(aq) + 2e- –>PbSO4(s) + 2H2O(l)
在負極或陽極,或石綿式鉛板上的反應,是
Pb(s) Pb2+(aq) + 2e—>Pb2+(aq) + SO4(aq) PbSO4(s)
Pb(s) + SO4(aq) –>PbSO4(s) + 2e-
總反應就成:
Pb(s) + PbO2(s) + 4H+(aq) + 2SO4(aq) –>2PbSO4(s) + 2H2O(l)
當的此反應發生時,就發出電流。假使要反回這些反應,就是加夠大的電壓充電,使反應向反方向進行,使電池回復原狀況,一般鉛蓄電池,包含有13或15片極板,三個電池串連,每電池可放2V,一個電池可有6V。
另一種普通電池,是Edison蓄電池 ( Edison battery ),用過氧化鎳如金屬錦作為正極,粉狀鐵作為負極,電解液是氫氧化鉀利氫氧化鋰的混合液,一般火車上應用此種電池,比重輕,但效力高。
有許多種蓄電池如鎳鎘 ( nickel cadmium ) 和銀鋅 ( silver-zinc )電池的在研究發展中,特別汽車汽油有空氣污染問題,如有大能量的蓄電池發展成功,蓄電池電動汽車無疑的將成為重要的交通工具。
*左圖是 Volta 所自製的 乾式電池單元。
*很多個單元串接一堆後 便形成 所謂的 伏打堆
(如下右圖)。

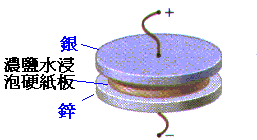
伏打所製作的 濕式電池,將兩不同金屬置於電解液中。
是現代汽車電池的前身。
鋅碳電池是最常用的乾電池,多用於電桶及小型收音機。
電池的正電極是一支被碳粉及氧化錳(IV)的混合物包圍的碳棒,是接收電子的地方。
電池的外殼由鋅造成,是電池的負電極,即是釋出電子之處。電解質是糊狀的氯化銨。
負電極上發生的氧化作用:
Zn(s) → Zn2+(aq)+2e-
正電極上發生的還原作用:
2NH4+(aq)+2e-→2NH3(aq)+H 2(g)
氫的導電性很差,在上述反應過程中,氫氣會在正電極積聚,會防礙反應繼續進行,減少電流。故要在電池內加入一種氧化劑——氧化錳(IV),以除去氫氣:
2MnO2 (s)+H2 (g) → Mn2O3 (s)+H2O(l)
鋅離子則與氨反應,生成絡合物:
Zn2+(aq)+2NH3 (aq)+2Cl-(aq) → Zn(NH3) 2Cl2 (s)
電池內的整體反應:
2MnO2 (s)+2NH4 Cl(aq)+Zn(s) → Zn(NH3) 2Cl2 (s)+H2O(l)+Mn2O3 (s)
電池內的總電壓為1.5V,這種電池適用於只需少量電流的電器,如電桶及小型收音機。
但此電池至少有兩個缺點,若電池放電太快便不能及時除去生成的氣體,令電壓減低,要暫停使用一會,電壓才能恢復到原來的水平。
此外這種電池的壽命亦較短,這是因為鋅電極及銨離子之間會有一種緩慢的直接反應。
一段時間後鋅外殼會變薄,電池內的糊狀化學藥品便會泄出,在電池外加上一層鋼製或膠製的外殼,可防止糊狀化學藥品泄出。
*鋅碳電池的大小型號 , 現時市面有多種不同大型號的鋅碳電池,分別為AAA、AA、C及D。AAA電池體積細小,多用於小型收音機。AA電池的使用最為廣泛。C及D型號電池的體積較大,可提供較多電能。
氧化錳電池
在乾電池未發明前,被廣泛使用為直流電來源的是銅鋅電池,但因乾電池密封組件中不使用流動液體,較輕便,且避免積聚氣體破壞容器,也免除了因氫覆住陰極而造成電池電位下降所以逐漸取代了銅鋅電池。在允許電子轉換及消耗反應所產生的氣體兩方面而言是一項偉大的發明。

乾電池是最通用的電池之一,又叫做Lechanche’電池,得名自發明家Georges Lechanche'(1893-1882)乾電池的負極是鋅罐,它常用鋼或紙板外套包圍,防止與大氣作用。正極是一支碳棒及外層包圍碳棒的二氧化錳(MnO2)和石墨粉的厚漿。兩電極之間填滿了NH4Cl和ZnCl2的飽和溶液和一些惰性漆料濕漿糊,當電極被連接時,負極的鋅即被氧化就失去電子(e-)。失去的電子便經由電線跑到正極使NH4Cl中解離出的NH4+離子還原,同時也形成氫氣。釋出的氫再被氧化錳所氧化,而NH3則被利用形成錯合物。
在負電極(陽極-氧化作用發生的地方)﹕
Zn(s) + 2OH-(aq) —-> ZnO(s) + H2O(l) + 2e-
在正電極-石墨和氧化錳(IV)的混合物(陰極-還原作用發生的地方)﹕
MnO2(s) + H2O(l) + 2e- —-> Mn2O3 (s) + 2OH-(aq)
電解質﹕氫氧化鉀
總反應﹕ Zn(s) + 2MnO2(s) —-> ZnO(s) + Mn2O3(s)
備注﹕當電池在操作中電池的外殼並不包括在化學作用中,所以電解質不會洩漏。
類型﹕原乾電池
電壓﹕1.5 V
形狀﹕圓柱體
大小﹕可有不同大小
 AAA
AAA  AA
AA  C
C  D
D  9V
9V
價格﹕較貴
好處﹕壽命較長, 電解質不會洩漏, 可存放較長的時間,
有穩定的電壓及大的電流
壞處﹕較貴,不可充電
用處﹕用於一些需要不斷有大電流提供的電器。如裝有摩托的玩具,錄音機,照相機。

負電極 – 鋅粉末 (陽極– 產生氧化作用)
Zn(s) + 2OH-(aq) —-> ZnO(s) + H2O(l) + 2e-
正電極 – 氧化銀 (陰極– 產生還原作用)
Ag2O(s) + H2O(l) + 2e- —-> 2Ag(s) + 2OH-(aq)
電解質 : 氫氣化鉀
類型 : 原電池
電壓 : 1.5伏特
形狀 : 鈕形
大小 : 有多種型號可供選擇
價錢 : 昂貴
優點 : 體積小,輕便,放電穩定,可長時間使用,可存放一段長時間
缺點 : 昂貴,非充電式,只可提供小電流,只可用於細小的儀器上,例如: 石英錶,計算機,助聽器和其他細小的電子儀器
現今最常見的可充電池有兩種,分別為鎳鎘(Nicd)、鎳氫(NiMH)。下表是它們一些基本分別:
比較項目 : | 鎳鎘(Nicd) | 鎳氫(NiMH) |
發明或商品化 | 1963年 | 1990年 |
個體電壓 | 每粒1.25V | 每粒1.25V |
壽命(可充放次數) | 500次 | 500至1000次 |
儲電量(同體積計) | 普通 | 較鎳鎘多40% |
重量 | 最重 | 最輕 |
電流負載 | 大 | 中 |
電量自動流失 | 每日1% | 每日3-10% |
惡性記憶 | 容易有 | 較少 |
定期放電 | 30天 | 90天 |
可接受充電方式 | 急充、快充、中充及慢充 | 快充、中充及慢充 |
飽和測試 | Delta V、最高電壓Delta V/T、0 | Delta、溫度 |
電池組短路保護 | 自動斷路開關 | 自動斷路開關 |
釋放有害氣體 | 會 | 少(因稱環保電池) |
潛在危險 | 失火 | 失火 |
成本 | 低 | 高 |
充電方式
【慢充】充電電流為電池本身容量的1/10(即所謂C/10或0.1C)或50mA,大約需要15小時充滿電池。
【中充】充電電流為電池容量的3/10(即0.3C),約5小時充飽。
【快充】電池相同容量的電流(1.0C)充一小時可飽。
【急充】只有鎳鎘電池可承受此特快充電方式,電池可於10分鐘內被充滿。

為於負極的鎘(Cd)和氫氧化鈉(NaOH)中的氫氧根離子(OH-)化合成氫氧化鎘,並附著在陽極上,同時也放出電子。電子沿著電線至陰極,和陰極的二氧化鎳與氫氧化鈉溶液中的水反應形成氫氧化鎳和氫氧根離子,氫氧化鎳會附著在陽極上,氫氧根離子則又回到氫氧化鈉溶液中,故氫氧化鈉溶液濃度不會隨著時間而下降。
反應式:
在負電極﹕鎘金屬(陽極-氧化作用於這裏發生)
Cd(s) + 2OH-(aq) —-> Cd(OH)2(s) + 2e-
在正電極﹕氧化鎳(IV)(陰極-還原作用於這裏發生)
NiO2(s) + 2H2O(l) + 2e- —-> Ni(OH)2(s) + 2OH-(aq)
電解質﹕氫氧化鉀
總反應﹕
Cd(s) + NiO2(s) + 2H2O(l) —-> Cd(OH)2(s) + Ni(OH)2(s)
鎳–鎘可充電電池(Ni-Cd Rechargeable Battery) | ||||||||||||||||||||||||||||||||
|